为帮助医疗企业更全面地了解俄罗斯及周边中亚医疗市场动态,抢抓机遇,12月2日下午,我司通过线上会议平台开展了《江苏贸促会展外贸大讲堂第六十五期“俄罗斯和EAEU市场医疗器械准入法规要求和注册流程”》公益讲座,从俄罗斯医疗市场前景与政策机会和俄罗斯及EAEU医疗器械注册法规要求等方面,为企业出海战略布局提供有效建议。会议吸引了来自江苏、广东、上海、天津、浙江、山西、河南、陕西等省份和直辖市近60名医疗行业企业上线参会,产品范围涉及医疗设备、医用耗材、实验室、骨科、康复类产品等。

俄罗斯医疗市场是全球最具规模与复杂性的市场之一。俄罗斯拥有约1.464亿人口,医疗机构约27,000家(包括医院和诊所),构成了一个巨大的需求基础。公立医疗系统的政府采购是医疗器械销售的核心渠道,市场透明度相对较高,但竞争也高度集中于价格与合规性。

在政策与监管层面,市场准入由俄罗斯联邦卫生监督局(RZN)严格管控,注册流程相对成熟,周期约9-12个月,但要求严格,包括强制性样品入境测试、本地临床试验以及针对中高风险产品的工厂质量体系审核。值得注意的是,基于新的1684法规正式实行电子注册证,提高了透明度。
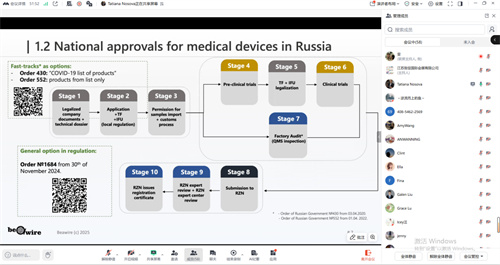
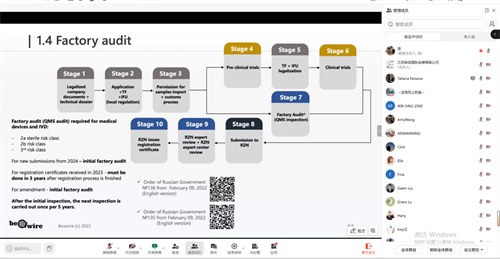
此外,根据俄联邦卫生部修订法规,自2024年1月1日起,对2a类、2b类及3类医疗器械实施强制性生产现场审核(验厂)。该审核是产品首次注册及注册证到期续证的必要条件,频率为每5年一次。审核将在制造商生产场地进行,海外企业(如中国工厂)也须接受俄罗斯授权机构的现场检查。同时,所有上述类别产品仍须完成临床前测试(技术测试)。常规流程需将样品邮寄至俄罗斯认可实验室检测;对于无法运输的大型设备,则可申请由俄方专家赴华进行现场测试。
新规显著提高了中高风险医疗器械的准入要求,企业必须同时满足“样品测试合格”与“生产体系通过现场审核”两大核心条件,方能获取或延续注册资格。
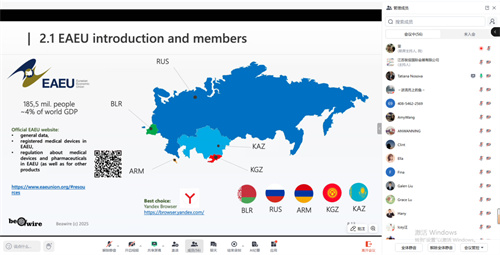
EAEU(欧亚经济联盟)医疗器械统一注册的核心目标是为联盟五国(俄罗斯、哈萨克斯坦、白俄罗斯、亚美尼亚、吉尔吉斯斯坦)创建“一张证书,通行五国”的市场准入路径,以替代此前各自为政的国家注册体系。然而,其实施过程是一个复杂且仍在发展中的并行与过渡体系,而非一个已完全成熟、运行流畅的单一程序。制造商向一个指定的“参考成员国”主管机构(如俄罗斯的RZN)提交申请,同时需要指定至少一个接受国,参照国和接受国审核通过方可取得证书。取得证书后,注册证书在所选参照国和接受国自动生效。
但EAEU注册的采用率极低,进展缓慢。目前绝大部分企业,包括国际和本地制造商,仍首选通过更成熟、可预测的各国家系统进入各国市场。EAEU注册流程极为漫长且复杂,通常需要18至24个月甚至更久。整个流程高度依赖一个在联盟内指定的授权代表,由其作为法定联系人,负责所有与主管机构的沟通、文件递交及上市后监管事务。
注册关键是对技术文件的深度审查,其要求综合了国际标准(如ISO13485质量管理体系)和联盟的特定规定。技术文件必须详细且完整,但各国监管要求仍未真正统一,各国在国家层面的实施细则、测试方法接受度、临床数据要求上仍存在“隐性”差异,导致审评过程充满不确定性。此外,对于中高风险产品(2b和3类),必须进行实际人体临床试验,因此注册时间会更长。
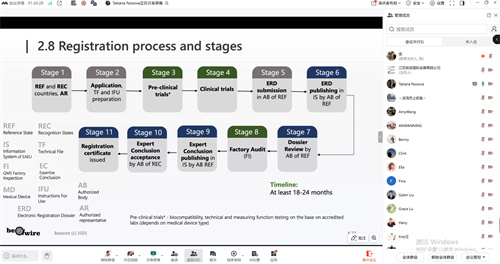
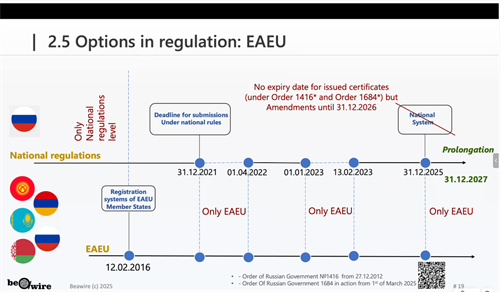
EAEU可以在已通过国家系统进入部分市场后,寻求进一步整合和简化五国注册状态的未来选项。目前EAEU整个体系仍处于过渡期,关键的法规切换时间点(2027年底)需要密切关注,并做好相应的预案。在可预见的未来,国家系统与联盟系统并存的“双轨制”将是俄罗斯及EAEU市场准入的常态。
最后的互动环节中,参会企业针对现在面对的俄罗斯医疗产品注册问题积极提问,嘉宾根据相关要求给出积极回应和建议,让企业对注册认证情况有了更清晰的了解。
我们始终致力于为外贸企业提供专业的培训和资源支持。未来,我们将继续举办更多高质量的分享活动,助力企业把握全球贸易新机遇,实现外贸新突破。欢迎大家持续关注,获取更多前沿资讯与行业信息。